Институт Физико-Химического Анализа Постоянной Комиссии по изучению Естественных Производительных Сил СССР (КЕПС) при Академии Наук возник по инициативе и плану Директора Института академика Н. С. Курнакова в 1917 г., но в силу развернувшихся тогда исторических событий получил возможность открыть свою деятельность лишь 11-го мая 1918 года.
Для уяснения задач, деятельности, достижений и вообще значения Института необходимо, хотя бы вкратце, охарактеризовать новую область физико-химических знаний — физико-химический анализ, — которому он посвящает свою исследовательную работу и который так много обязан в своем развитии Н. С. Курнакову.
В основе современной физической химии лежит представление о равновесии химической системы, образованной определенным числом независимых составляющих веществ или компонентов; с этим представлением неразрывно связаны понятия о непрерывности и обратимости химического превращения. Они ведут начало от знаменитого основателя химической механики и учения о равновесиях Клод-Луи Бертолле. Бертолле распространял непрерывность изменения и на самый состав твердых веществ, получающихся в результате взаимодействия, и утверждал, что отношения, в которых тела вступают во взаимодействие, не остаются постоянными, а меняются вместе с условиями реагирования. В качестве примеров Бертолле приводит металлические сплавы, стекла, растворы; состав их меняется без нарушения их однородности; ныне они определяются термином "фаза переменного состава". Против этих выводов восстал известный французский химик Жозеф Луи Пру. На основании аналитических данных он доказывал, что веса составных частей соединения находятся в постоянном отношении, независимо от условий его получения. Между противниками возгорелся знаменитый в истории химии семилетний спор (1801—1807), приковавший внимание современного ученого мира. Поле сражения осталось в то время за Пру, и его победа направила работу химиков почти на целое столетие к изучению определенных химических соединений, подчиненных "закону Пру". Химики получали, анализировали, характеризовали, классифицировали и предсказывали эти "чистые вещества". По отношению к простым телам предсказания, свидетельствующие о глубоком проникновении в их природу, были сделаны бессмертным творцом периодического закона — Д. И. Менделеевым, подробно описавшим свойства трех неведомых элементов: экабора, экаалюминия и экасилиция; открытые при его жизни скандий, галлий и германий заняли в Менделеевской таблице предуказанные им места и точно обнаружили предписанные им свойства.
От одного чистого вещества к другому можно перейти скачком, с разрывом в составе и свойстве вещества. Этими разрывами химия противополагалась физике, где превращение протекает непрерывно и обратимо, где каждое состояние физической системы представляет равновесие. Отсюда — возможность применять математический анализ с его понятием о непрерывности функции и выводы термодинамики при решении физических вопросов. Отсюда глубокое различие в методике физических и обычных химических исследований: из многочисленных и сложных физических приборов, приспособленных большею частью к наблюдению последовательных состояний равновесия, химия с ее разрывами в составе и свойствах взяла себе лишь весы да термометр, присоединив к ним впоследствии спектроскоп.
Идеям Бертолле суждено было, однако, возродиться.
Генрих Сент-Клер Девилль открывает в конце 50-х годов прошлого века явление диссоциации прочнейших химических соединений под влиянием высокой температуры и устанавливает понятие об обратимости химического процесса. Интересно, что он пришел к этому открытию, создавшему эпоху в истории химии, при решении практических вопросов по металлургии платины. Далее норвежские ученые Гульдберг и Вааге дают точную математическую формулировку и экспериментальное доказательство закона действующих масс, предугаданного Бертолле. Новая область химии, оживленная понятиями непрерывности и обратимости превращений, позволяет применять математический анализ и термодинамику для решения чисто химических задач, что представляло раньше, как мы видели, удел физики. В 1873—78 гг. американский теоретик Виллард Гиббс печатает в трудах Коннектикутской Академии свои классические работы относительно равновесий химических систем. Здесь были впервые установлены понятия о фазах и компонентах, оказавшие впоследствии большое и плодотворное влияние на развитие учения о химических равновесиях. Работы Гиббса имеют отвлеченный, чисто математический характер. Химия удовлетворила, наконец, суровым требованиям, предъявленным к науке Кантом, из под пера которого вышли слова: "Я утверждаю, что в каждой отдельной естественной науке можно найти собственно науку лишь постольку, поскольку в ней можно найти математику". Однако, по причине отвлеченности изложения и недоступности математического метода большинству химиков идеи Гиббса долгое время не находили себе применения, пока Ван-дер-Ваальс и Розебум со своими учениками не доказали их плодотворности целым рядом экспериментальных работ.
В настоящее время идея непрерывности химического превращения вещества с особенною яркостью, ясностью и плодотворностью и в совершенно новом освещении развивается академиком Н. С. Курнаковым. Она воплощена им в общем учении о равновесной химической диаграмме "состав-свойство". Это учение примиряет несовместимые, казалось, представления Бертолле о непрерывности превращения с разрывами, характеризующими определенные соединения, подчиняющиеся стехиометрическим законам Пру и Дальтона.
Методы прежней химии, характеризовавшейся разрывами, не пригодны, конечно, для изучения равновесных систем. Непрерывное и обратимое превращения этих систем сходны с превращениями физическими, и методы должны быть похожие. Сущность их сводится к следующему. Пусть перед нами равновесная система, образованная определенными составляющими ее веществами, компонентами. Выбираем какое-нибудь измеримое свойство нашей системы (напр. температуру, давление, электропроводность, внутреннее трение и т. д.). Образуем ряд равновесных состояний для различных составов, т. е. отношений компонентов нашей системы. Измерим для этих состояний величину выбранного свойства. Зависимость между составом и измеренным свойством выразим графически; получается диаграмма "состав-свойство", по виду которой можно судить о числе и химической природе однородных составных частей или "фаз" равновесной системы. Простейший вид такой диаграммы равновесной системы из двух компонентов представляют, например, кривые растворимости соли в воде, впервые полученные еще Гей-Люссаком. По оси абсцисс откладывается температура (t), по оси ординат — состав (x) насыщенного при этой температуре раствора. Значение этих кривых в ту пору не было ясно. К таким же диаграммам "состав-свойство" принадлежат кривые удельного веса растворов, на основании которых Д. И. Менделеев в своем классическом "Исследовании водных растворов по удельному весу" стремился постичь химическую природу их и создал свою знаменитую гидратную или химическую теорию растворов. Великий русский химик как-бы завещал последующим поколениям химиков — "русской химической дружине", как он выразился в одном из своих писем,искать проявление химизма в растворах.
Мы подошли теперь к выяснению содержания термина "физико-химический анализ", введенного в науку Н. С. Курнаковым. Под ним разумеется новый обширный отдел общей химии, имеющий целью изучение соотношения между каким-либо измеримым свойством равновесных систем и составом этих систем, образованных двумя или более независимыми слагающими веществами или "компонентами". Полученная диаграмма "состав-свойство" заключает точные данные для определения взаимодействия между компонентами. Для физико-химического анализа в той стадии, как он ныне развивается, наиболее характерной его особенностью нужно считать приложение геометрии к изучению соотношений между составом и свойствами равновесных систем. Новые методы физико-химического анализа дают возможность решать вопросы о физико-химических отношениях и химической природе твердых, жидких и газообразных фаз, не прибегая к обычным ранее операциям их разделения и очищения. Это составляет характерный признак и преимущество этих методов. Металлические сплавы, стекла, шлаки, жидкие и твердые растворы-вещества, которые столь долго ускользали от обычных методов химического исследования, ныне не в силах сопротивляться всемогущему физико-химическому анализу и постепенно открывают исследователю тайну своей химической природы.
Приложения физико-химического анализа в пограничных областях теоретического и прикладного знания — бесчисленны. Для объяснения этого достаточно вспомнить, что некогда происходившие в земной коре процессы образования горных пород при кристаллизации остывающей магмы, отложения солей при испарении вод океанов и морей, современные искусственные процессы металлургии при получении металлов и их сплавов, их термическая обработка, наконец, работа частей машин и зданий — все это в огромном большинстве представляет ряд последовательных равновесных систем. Поэтому минералогия, петрография, геология, металлургия, прикладная и строительная механика широко пользуются методами и выводами этой молодой ветви химии. Отсюда понятно, какое огромное значение имеет она при изучении и использовании естественных богатств нашей страны.
Остановимся несколько на некоторых методах физико-химического анализа. Один из первых — изучение при помощи микроскопа структуры шлифов металлических сплавов, соответственным образом подготовленных и протравленных — микро-графический анализ. Честь первого применения микроскопа (1831) для этой цели принадлежит, как ныне установлено, русскому горному инженеру П. П. Аносову, начальнику Златоустовских заводов на Урале. Определение свойств булатных стальных клинков при помощи микроскопа было сделано им более, чем на 30 лет раньше англичанина Сорби, который в 1863 году начал систематическое изучение горных пород и металлов в проходящем и отраженном свете также при помощи микроскопа. Другой наш соотечественник, Д. К. Чернов, называемый американцами по справедливости "отцом металлографии", указал в 1868 г. на существование характерных температурных точек, при которых происходят взаимные превращения структурных составляющих углеродистого железа; они получили название "точек Чернова". Затем французский инженер Осмонд применял для их точного измерения термоэлектрический пирометр Ле-Шателье. Таким образом, было положено начало термическому анализу, получившему дальнейшее развитие, благодаря работе ряда исследователей в различных странах. Кривые плавкости (растворимости), дающие температуры (t) равновесных систем различного состава (x), образованных данными компонентами, явились простейшими представителями диаграммы "состав-свойство". Микрографический и термический методы оказались классическими в области металлографии — учения о взаимодействии при сплавах металлов, интерес к которым особенно возрос со времени открытия Менделеевым периодического закона.
В России систематические металлографические исследования и разработка основных металлографических методов были начаты Н. С. Курнаковым с 1900 г. в Лабораториях Горного, Политехнического и Электротехнического Институтов в Ленинграде, при участии многочисленных учеников-сотрудников. Благоприятные результаты, полученные при этом, дали русской металлографии возможность оценить новые приемы изучения ранее, нежели это было сделано в Западной Европе. Начиная с 1906 г. в двух первых названных лабораториях Н. С. Курнаковым были последовательно введены в круг наблюдения новые свойства — электропроводность, твердость, вязкость; они дали возможность установить чрезвычайно тонкие различия в превращении веществ. В результате этих работ возникла в России "школа Курнакова", давшая кадры готовых исследователей в области физико-химического анализа и сопричастных отраслей химии.
При открытии Института Физико-Химического Анализа ученики объединились под знамя своего учителя для коллективной работы по определенному плану. Необходимость перехода к коллективной работе становилась все ощутительней. Во-первых, при распространении исследования на системы с большим числом компонентов построение диаграммы "состав-свойство" требует большего количества числового материала и наблюдения становились не под силу одному лицу; например, для построения тройной диаграммы плавкости известь-глинозем-кремнезем, имеющей чрезвычайно важное практическое значение, и исследованной в Геофизической Лаборатории в Вашингтоне Шефердом, Рэнкином и Райтом, потребовалось измерение более 500 точек и до 5.000 отдельных термических и оптических измерений. Во-вторых, число измеримых свойств для построения диаграммы быстро расло и в настоящее время превышает двадцать; для всестороннего выяснения взаимодействия между компонентами нередко применяется несколько методов.
Переживаемые государством тяжелые финансовые затруднения не позволяли думать о постройке для Института нового здания со специально оборудованными лабораториями и штатом. Поэтому КЕПС нашел возможным использовать для достижения целей Института научные силы уже существующих и работающих в этом направлении лабораторий: Академии Наук, Горного и Политехнического Институтов.
Из сказанного до сих пор становятся ясными цели, поставленные себе Институтом:
а) разрабатывать общие методы для определения отношений между составом и измеримыми свойствами равновесных химических систем;
б) прилагать названные методы к планомерному исследованию металлических сплавов, жидких, твердых и др. растворов, которые могут иметь значение для изучения и использования производительных сил СССР.
При обозрении деятельности и достижений Института мы начнем с приложений.
На необозримом пространстве Арало-каспийского и Черноморского бассейнов разбросаны в громадном количестве соляные озера, заливы и лиманы, составляющие одно из крупных природных богатств СССР. Из них особенно выделяется Карабугаз — единственный в мире по своему богатству источник глауберовой соли (Na2SO4 · 10H2O), которая в форме "сульфата" (Na2S4) имеет широкое применение в химической промышленности. Институт включил в программу своей деятельности научное лабораторное исследование естественных процессов солеобразования в различных озерах, ибо, только составив ясное представление об этих процессах, можно создать правильную добычу и дальнейшую переработку различных солей. Работа эта была начата под руководством Н. С. Курнакова Соляным Отделом Комиссии, вошедшим затем (с 1919 года) в состав Института — Ф.X.А. Путь для изучения сложных соляных равновесий был уже проложен знаменитыми исследованиями Вант-Гоффа и его сотрудников над образованием Стассфуртских соляных залежей. Отложение солей в морских заливах, лиманах и соляных озерах по существу связано с равновесными состояниями системы солей:
| 2NaCl + MgSO4 | → | MgCl2 + Na2SO4 |
| ← |
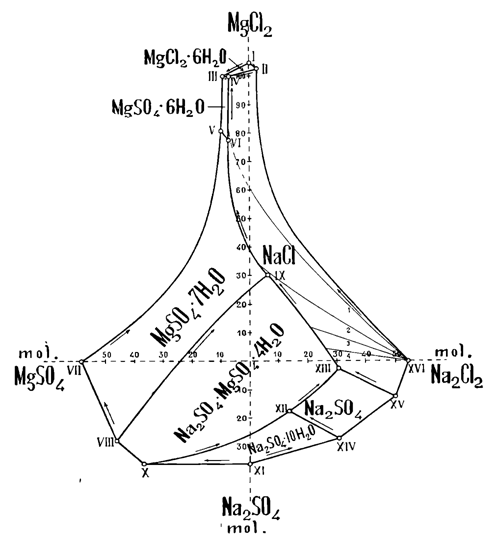
Эти равновесия были изучены Н. С. Курнаковым и С. Ф. Жемчужным для 0° и 25° и результаты изображены в форме геометрической диаграммы важнейшего практического значения.
На фиг. 1 представлена горизонтальная проекция нижней части правильного октаэдра, поставленного на вершину, внутри которого расположены соответствующим образом результаты лабораторных наблюдений растворимости. Две взаимно-перпендикулярные оси (пунктиры на чертеже) определяют горизонтальные оси октаэдра; по ним расположены четыре указанные соли. Мы видим на диаграмме семь "полей кристаллизации" солей, образующихся при температуре 25°. Они обозначают границы устойчивого состояния этих солей и дают технику надежные указания для получения нужной ему соли в чистом виде. На поле выделения хлористого натрия, главнейшем в практическом отношении, нанесены исследованные авторами "пути кристаллизации" этой соли: 1, 2, 3, 4. Они дают возможность развернуть наглядную картину последовательного хода кристаллизации при испарении воды озера данного состава и позволят заранее предсказать порядок выделения отдельных солей в природе при данных условиях. Например, диаграмма показывает, что при испарении воды Карабугазского залива при 25° первою выделяющейся солью будет хлористый натрий. Лишь при понижении температуры до 5,5°, как показывают дальнейшие исследования, начинает первою выделяться глауберова соль. Диаграмма Н. С. Курнакова и С. Ф. Жемчужного послужила основанием для разработки в промышленном масштабе технического способа обезвоживания глауберовой соли теплом солнечной энергии (В. П. Ильинский и В. П. Шишокин).

В 1921 году Институт совместно с Карабугазским Комитетом и Главным Управлением Горной Промышленности ВСНХ организовал научную и промышленно-техническую экспедицию в Карабугаз под начальством Н. И. Подкопаева для производства годичного цикла гидрометеорологических и химических наблюдений. Экспедиция оборудовала две гидрометеорологические станции в Карабугазском проливе и на северо-западном берегу залива. Она собрала обширный и ценный материал, всесторонне характеризующий режим Карабугаза. Она проследила и исследовала периодическую кристаллизацию и растворение глауберовой соли в заливе. С глубоким удовлетворением нужно признать, что выводы лабораторных исследований вполне подтвердились этими работами экспедиции в самом заливе. Измерения показали для начала выделения и растворения глауберовой соли температуру в заливе равною 5,6—5,0°, отличающуюся очень мало от величины, наблюденной в лаборатории.
Институт исследовал также и Соликамские калиевые месторождения, где впервые в СССР было открыто Г. Р. Дерингом и установлено Н. С. Курнаковым, К. Ф. Белоглазовым и М. К. Шматько нахождение калиевого минерала. Понятно, какое огромное значение имеют калиевые соли для нашей земледельческой страны, нуждающейся в удобрении. Полученные результаты требуют горно-разведочных работ. К. Ф. Белоглазов, при содействии Геологического Комитета, производил на месте опыты уваривания природных соляных рассолов для выяснения заводских способов получения калиевых и магнезиальных солей; в этих рассолах при этом впервые обнаружен иод.
В 1924/25 годах КЕПС организовал экспедицию на Сакское и другие Крымские озера для продолжения начатых им во время войны наблюдений над испарением соляных рассолов и выработки методов получения магниевых и калиевых соединений. В качестве интересного результата следует указать на обнаружение впервые в СССР минерала бишофита в соляных отложениях озера Старого.
Институтом произведены также аналитические исследования природных рассолов и солей и разработка относящихся сюда методов анализа (Н. Н. Ефремов, Г. Г. Уразов).
События последних лет показали с полною ясностью необходимость организации собственной алюминиевой промышленности. Металл этот необходим в авиационном деле, в военном деле, в целом ряде технических производств, и зависимость от заграничного ввоза его особенно тягостна. До последнего времени у нас не было известно подходящих естественных материалов, и открытие КЕПС'ом в 1915 г. (В. И. Искюль) в Тихвинском уезде бокситовых пород среди каолинитовых глин имеет большое значение для обоснования русской алюминиевой промышленности. Возник интересный вопрос о выяснении природы этих рудных образований, весьма сложных в физико-химическом отношении и принадлежащих, повидимому, к веществам коллоидного типа. Термический анализ (метод нагревания), примененный Н. С. Курнаковым и Г. Г. Уразовым, дал весьма благоприятные результаты; по остановкам на кривых нагревания удалось установить диаспоровый и гидраргиллитовый типы бокситов. Новые методы раскрыли тонкие различия в строении этих сложных веществ, ускользавшие от прежних способов исследования. Результаты эти пригодятся при определении степени практической пригодности наших бокситов. Метод нагревания осветил химическую природу столь важных в практическом отношении веществ, как естественные гидраты окиси железа — бурые железняки, болотные и бобовые руды (Н. С. Курнаков и Е. Я. Роде). При помощи этого метода в сочетании с оптическим методом, исследованы минералы брусит (водная окись магния) и змеевики (Н. С. Курнаков и В. В. Черных). Наконец, применение термического анализа Г. Г. Уразовым в Лаборатории Геологического Комитета к исследованию Боровичских огнеупорных глин дало возможность охарактеризовать различные их сорта ("сухарь", "мыленка").
Из числа особенно ценных природных веществ физико-химическому исследованию были подвергнуты С. Ф. Жемчужным самородки платины и золота, при чем получилась возможность коснуться вопросов их генезиса.
Исследованы физико-химические свойства торфяного кокса (Н. Н. Курнаков).
Обширная группа исследовательских работ Института касается области металлических сплавов — металлографии. Изучались двойные и тройные системы, имеющие практическое применение в технике или представляющие теоретический интерес. К первым относятся сплавы железа с алюминием (Н. С. Курнаков, Г. Г. Уразов, А. Т. Григорьев); знание их химической природы необходимо для разъяснения ядовитых свойств технических сплавов железа с кремнием (ферросилиция). Некоторые сорта продажного ферросилиция при хранении, особенно при перевозке морем, выделяют ядовитые газы, при чем известны смертельные исходы отравления ими. Прежние исследования Н. С. Курнакова и Г. Г. Уразова показали, что эти явления связаны с существованием в сплавах железа с кремнием особой фазы переменного состава, названной лебоитом. Очень стойкий в чистом состоянии, лебоит может давать сложные твердые растворы с алюминием, фосфором и мышьяком; они способны рассыпаться при реагировании с влагою воздуха и выделять ядовитые соединения фосфора и мышьяка с водородом. Важное практическое значение имеют и тройные сплавы железа с фосфором и углеродом, исследованные Н. С. Константиновым, столь безвременно утраченным наукою. Сюда же относятся легкие сплавы типа дуралюмина, имеющего ныне столь большое значение в воздухоплавании; в Институте изучались сплавы магния с алюминием (Г. Г. Уразов) и богатые алюминием сплавы с медью (П. Я. Сальдау и Н. Г. Анисимов); для последних особенно интересно в практическом отношении явление "старения" — улучшения механических свойств со временем. Наконец, к этой же категории принадлежат сплавы высокого электро-сопротивления и малого температурного коэффициента — сплавы типа манганина и константана (С. Ф. Жемчужный, В. А. Немилов, С. А. Погодин), широко применяющиеся в электротехнике и физике для постройки реостатов, магазинов сопротивления и т. д. Произведенные исследования дали возможность приготовить впервые в СССР в заводском масштабе образцы манганина. Сплавы золота с цинком, изучавшиеся П. Я. Сальдау, имеют теоретический интерес в связи с выяснением природы латуни, важнейшего в практическом отношении и исстари известного сплава; в состав ее вместо золота входит медь — аналог золота в системе Менделеева. Теоретический интерес представляют и золото-сурьмяные сплавы, исследованные А. Т. Григорьевым. Г. Г. Уразовым изучены явления прохождения электрического тока через сернистые соединения серебра и меди.
В пору хозяйственной разрухи, когда музеи Ленинграда, на ряду с другими общественными зданиями, не могли быть отапливаемы, на некоторых оловянных вещах исторического значения появились признаки "оловянной чумы". Болезнь состоит в том, что обыкновенное белое олово при низкой температуре переходит в другую, серую модификацию, устойчивую при температуре ниже 20°. Удельный вес серого олова значительно меньше белого, и переход ведет к распадению оловянной вещи. При 20°, точке перехода, обе модификации устойчивы. Институт был привлечен к борьбе с бедствием, угрожавшим гибелью зараженных вещей. Дело сводится к скоростям взаимных превращений обоих модификаций. По этому поводу Н. И. Степановым была предложена и исследована в общем виде формула, выражающая зависимость скоростей превращения и температуры систем, обладающих точкой перехода.
Помимо металлических сплавов, в круг исследования Института включены были взаимодействия веществ иного характера. Н. Н. Ефремовым изучен по методу плавкости целый ряд взаимных соединений органических веществ; многие из них играют видную роль в органических синтезах, или имеют практическое применение для приготовления взрывчатых веществ. Б. Н. Меншуткин при выяснении последовательности реакций в некоторых органических превращениях применил результаты изучения реагирующих?систем по методу плавкости. А. Г. Бергман и Т. А. Генке исследовали вопрос об обменном разложении в отсутствии растворителя, изучая двойные и тройные диаграммы плавкости минеральных солей. Н. Н. Нагорнов измерил теплоту образования изоморфных солей некоторых органических веществ.
В настоящее время Н. С. Курнаковым и его сотрудниками (И. А. Андреевский, А. Г. Бергман) разрабатывается и применяется тензиметрический метод исследования, где измеряемым свойством равновесной системы является упругость пара.
Из сказанного видно, как действительно многочисленны и многообразны приложения физико-химического анализа в различных отраслях естествознания и техники. Число их все возрастает. Может показаться, что новая дисциплина имеет главным образом прикладной, практический характер. Это не так. Ее новые методы, несравнимо более могучие, чем старые методы химического исследования, ведут к новым научным достижениям, создают новые понятия, подготовляют пути для разрешения основных вопросов о превращении вещества. Остановимся на этой важной стороне деятельности Института.
К числу крупных научных приобретений современной физической химии бесспорно принадлежит понятие о твердом растворе, введенное Вант-Гоффом в конце прошлого столетия. Под ним мы разумеем однородное твердое вещество, состав которого может изменяться без нарушения однородности (твердые фазы переменного состава). Уже самое название указывает на аналогию между явлениями растворения в твердом и жидком состоянии. Обширные исследования Н. С. Курнакова и его школы в области изучения различных свойств фаз переменного состава, твердых и жидких, привели Н. С. Курнакова к открытию нового типа диаграммы "состав-свойство", именно диаграмм "рационального типа", с "сингулярными" или "дальтоновскими" точками. Эти диаграммы характеризуются тем, что при непрерывном изменении состава твердого или жидкого раствора кривая свойства выражается двумя пересекающимися под углом ветвями одной и той же кривой. Состав, отвечающий точке пересечения — сингулярной точке, — подчинен закону постоянных и кратных отношений (Дальтона); он остается неизменным с изменением условий равновесия для всех свойств фазы. Сингулярные точки на диаграммах представляют фактическое осуществление тех разрывов в сплошности кривых свойств, которые Д. И. Менделеев положил в основу своих представлений о природе растворов. Сингулярные точки приобретают особо важное значение в вопросе о типах химического взаимодействия, об определенных и неопределенных соединениях. Теперь мы знаем, что не состав однородного твердого вещества характеризует определенное соединение, потому что он часто может изменяться, а постоянный состав сингулярной или инвариантной точки на диаграмме свойства вещества. Непрерывность изменения состава твердого раствора, приложение возрожденного Н. С. Курнаковым принципа непрерывности к диаграмме, выраженной одной и той же кривой и кажущиеся разрывы в сингулярной точке диаграммы — примиряют несовместимые, казалось, представления Бертолле и Пру о природе химического соединения. Вся совокупность данных физико-химического анализа показывает, что обе стороны правы, но точка зрения Бертолле является более общей. Диаграммы физико-химического анализа устанавливают с несомненностью существование тесной связи между геометрическим преобразованием пространства и химическими превращениями вещества. В связи с учением Н. С. Курнакова о сингулярных элементах химической диаграммы экспериментальные исследования Института были направлены на отыскание и изучение их. В тройной системе — соляной кислоты, окиси натрия, воды — Н. С. Курнаковым в сотрудничестве с Т. А. Генке впервые была установлена сингулярная складка в химическом пространстве диаграммы; она сопровождает образование недиссоциированной соли при реакции нейтрализации соляной кислоты сильным основанием. Аналогичная сингулярная складка наблюдалась для азотно-натриевой соли в системе азотный ангидрид — окись натрия — вода (Н. С. Курнаков и В. И. Николаев) и в системе окись калия — соляная кислота — вода (Б. А. Муромцев). Изотермы растворимости солей здесь взаимно пересекаются, образуя входящий угол. Применяя соответствующие геологические термины, подобные складки можно назвать синклинальными. На фиг. 2 изображен общий вид схемы синклинали недиссоциированного соединения AB. ABC — основной треугольник состава тройной системы, образованной компонентами A, B и C. На перпендикулярах к нему отложена температура (t). Кривые плавкости соединения Ma и Mb пересекаются в сингулярной точке MМ; из нее исходит ребро складки Mm, представляющее кривую понижения температуры плавления (t) соединения AB под влиянием жидкого компонента C (наприм., воды). В этом ребре происходит пересечение под входящим углом двух поверхностей, образующих крылья пространственной складки. Изотермы amb и a1m1b1 синклинальной складки имеют сингулярную точку m и m1. В. И. Николаевым установлены новые сингулярныё элементы: изотермическая плоскость и пространственное ребро.
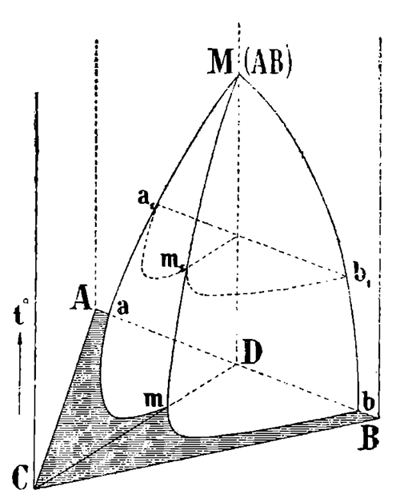
Сингулярные точки диаграммы представляют геометрические инварианты и характеризуют состав определенных соединений, которые являются химическими инвариантами, ибо они неизменны при превращениях равновесий системы. Соотношение между геометрическими и химическими инвариантами лежит в основе химической диаграммы и определяет весь ее строй. "При таких условиях вещество и пространство, можно сказать, взаимно проникают друг в друга, они кажутся неотделимыми" (Н. С. Курнаков). Н. И. Степанов вывел теоретически форму изотермической кривой растворимости твердого тела в сложном растворителе из двух компонентов, когда между ними образуется одно определенное химическое соединение. Оказалось, что при отсутствии диссоциации образовавшегося соединения кривая растворимости обладает сингулярной точкой, отвечающей составу соединения. При диссоциации соединения сингулярная точка исчезает. Мы имеем теоретическое обоснование появления и исчезновения сингулярной точки; в этой области сингулярность не была наблюдена. Для простейшего случая химического превращения, протекающего в среде раствора, оно сводится к весьма простому преобразованию пространства: изменению взаимного положения плоскости и некоторого неизменного конуса, названного "Дальтонианом". Выводы эти при помощи Новой Геометрии были распространены автором и на тройную систему. Экспериментальные исследования растворимости нафталина в смесях анилина с аллиловым горчичным маслом, произведенные Н. И. Степановым при сотрудничестве С. В. Липина, дали сингулярные изотермы растворимости, в полном согласии с теорией.
Последние достижения общего учения Н. С. Курнакова о диаграмме переносят нас в область грандиозных обобщений Эйнштейна-Минковского, осуществивших слияние основных понятий о времени, пространстве и веществе в одно общее многообразие четырехмерного мира.
Результаты работ сотрудников Института сообщаются в заседаниях, число которых за время существования Института достигло 55. На них было сделано 92 научных доклада. Иногда заседания происходят совместно с другими учреждениями, близкими к Институту по своей деятельности или заинтересованными в его работе. Результаты работ печатаются в журнале: "Известия Института Физико-Химического Анализа", выходящем под редакцией Н. С. Курнакова и Б. Н. Меншуткина. Помимо оригинальных статей и извлечений из протоколов заседаний Института в форме кратких рефератов о работах, в журнале помещаются еще переводы основных работ по физико-химическому анализу, с целью распространения среди молодых русских исследователей сведений о методах этой новой научной дисциплины. В журнале напечатан составленный Б. Н. Меншуткиным указатель двойных органических систем, исследованных термическим анализом. До настоящего времени вышло 4 выпуска, составляющие 2 тома, объемом 68 печатных листов.
Рефераты об исследованиях и докладах Института помещаются в "Сообщениях о научно-технических работах в Республике".
Институт объединяет не только своих сотрудников: целый ряд исследователей, работающих в его области, — главным образом — ученики школы Курнакова — сообщают о своих результатах в заседаниях Института и печатают свои статьи в его журнале. Группа молодых исследователей (Н. А. Трофимов, В. Я. Аносов и их сотрудники) работает в Физическом Институте Саратовского Университета и достигла интересных результатов при изучении физических свойств бинарных жидких систем (магнитная восприимчивость, рефракция).
Подводя общий итог характеристике деятельности Института Физико-Химического Анализа, мы должны отметить ярко выраженное сочетание научных исследований и практических результатов в вопросах изучения и использования естественных богатств СССР. Смысл и значение этого гармонического сочетания чисто научных достижений и практической пользы прекрасно очерчены следующими словами Д. И. Менделеева:
"Лишь тогда, когда узнаются истины сами по себе, в их абсолютной чистоте, они могут самостоятельно прилагаться к жизни, не будет одной слепой подражательности и родится сознательная любовь, соединенная с стремлением к прогрессу".
..."Посев научный взойдет для жатвы народной".