Я. К.
Часто приходится слышать от радиолюбителей жалобы: «Тратишь столько денег на аккумулятор, а он так быстро портится». Многих из этих жалоб не было бы, если бы все радиолюбители ясно представляли себе сущность процессов, происходящих в аккумуляторах, и необходимость определенного ухода за ними для того, чтобы нормальное течение этих процессов не нарушалось. Объяснение этих процессов мы и попытаемся дать в предлагаемых статьях.
Аккумулятором мы называем такой источник тока, который способен возобновлять свою истощенную электрическую энергию, черпая ее у какого-нибудь внешнего источника электричества. Восстановление энергии аккумулятора выражается в накоплении на электродах продуктов электрического распада. В свинцовом аккумуляторе это накопление состоит в том, что отрицательная пластина (катод) по окончании зарядки будет покрыта губчатым металлическим свинцом, — массой серо-металлического вида, а положительная пластина (анод) покрыта перекисью свинца (Pb2O5)1) черного цвета, нестойким (легко разрушающимся) веществом, обладающим большой электропроводностью. После нормального разряда электроды (анод и катод) имеют совершенно другой внешний вид и химический состав. Анод превращается из черного в бурый, состоящий из двуокиси свинца (PbO2) с электропроводностью в 22 раза меньшей, чем у перекиси свинца (Pb2O5). На катоде же образуется слой темносерого почти черного цвета, так называемого недокислого сернокислого свинца, обладающего большой проводимостью.
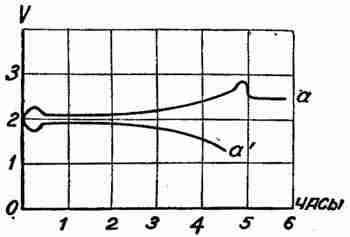
Если мы построим кривые разряда и зарядки, при некотором одинаковом зарядном и разрядном токе аккумулятора, причем горизонтальная ось (рис. 1) указывает время в часах, а вертикальная — напряжение в вольтах, то мы увидим, что эти кривые не совпадают между собой и площадь между ними выражает потерю энергии на цикл зарядки и разряда. Площадь дает разность энергии, пропущенной через аккумулятор при зарядке и отданной им при разряде. Эта потерянная энергия составляет примерно 20—30% всей энергии, пропущенной через аккумулятор при зарядке.
Теперь мы попробуем выяснить вопрос: «а что же собственно происходит при зарядке и разряде? Какие химические процессы при этом совершаются в аккумуляторе?»
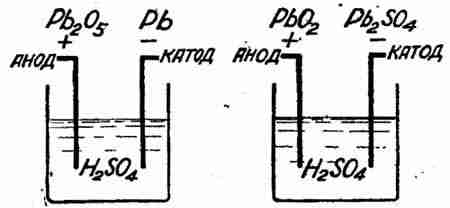
Французский ученый Фери сравнительно недавно внес в этот вопрос полную ясность. Заряженный свинцовый аккумулятор, — это система из губчатого свинца на катоде и перекиси свинца Pb2O5 на аноде, погруженная в раствор серной кислоты (рис. 2). При разряде происходит следующее: свинец на катоде разъедается серной кислотой и дает на нем слой недокислого сернокислого свинца. Водородный же ион кислоты (остаток кислоты после соединения ее со свинцом), освободившись, направляется к аноду, отнимает от перекиси часть кислорода и превращает ее в двуокись свинца (PbO2), сам же дает воду (H2O) (рис. 3). При зарядке, наоборот, водородный ион разлагающейся воды направляется к катоду и, отнимая «SO4», восстанавливает металлический свинец, а сам дает серную кислоту. Кислородный же ион окисляет двуокись свинца PbO2 на аноде в перекись Pb2O5 (рис. 2).
 |
|
Рис. 2. |
Рис. 3. |
В этой части процесс разряда является нормальным и дает возможность легко вновь зарядить аккумулятор. Но если мы доведем разряд аккумулятора до напряжения ниже 1,85—1,80 в., то процесс разряда вступает в следующую стадию, протекающую очень быстро и ведущую в дальнейшем к большим трудностям при новой зарядке. Дело в том, что напряжение в 1,78 в. соответствует точке перелома, ниже которой невозможно существование соединения недокислого сернокислого свинца (Pb2SO4). Именно это соединение, как мы знаем, образуется на катоде при нормальном разряде аккумулятора. Если разность потенциалов между электродами падает ниже 1,85—1,80 в., то это значит, что соединение Pb2SO4 легко восстанавливающееся до металлического свинца, при зарядке, переходит в трудно растворимое, почти не проводящее, белого цвета соединение сернокислого свинца (PbSO4). Этот процесс носит название «сульфации». Процесс этот гибельный для аккумулятора, так как ведет к необходимости удаления с электродов этого слоя сернокислого свинца, а следовательно, к уменьшению массы электродов, уменьшает продолжительность жизни аккумулятора и лишает процесс возобновления заряда аккумулятора присущей ему простоты.
Для лучшего уяснения процессов зарядки и разряда аккумуляторов приводим следующую таблицу.
| Стадия | Зарядка | Разряд |
| Занимает короткое время | ||
| 1-я. | Разность потенциалов на пластинах поднимается до 2,1 вольт. | Сперва разность потенциалов быстро падает до 1,9 в. |
| Занимает наибольшую часть | ||
| 2-я. | Разность потенциалов медленно возрастает приблиз. до 2,2 в. | Разность потенциалов медленно убывает прибл. до 1,85 в. |
| Занимает сравнительно небольшое время | ||
| 3-я. | Разность потенциалов довольно быстро возрастает до 2,5—2,6 в. | Разность потенциалов быстро падает и стремится к нулю. |
Мы специально довольно подробно освещаем процесс разряда, чтобы всем радиолюбителям стало ясно, что ни в коем случае нельзя доводить аккумуляторы до 3-й стадии разряда, т. е. до напряжения ниже 1,8 в. Чтобы закончить с теорией зарядки и разряда мы должны остановиться на влиянии саморазряда аккумуляторов. Свинцовый аккумулятор обычного типа даже при хорошем содержании теряет не менее 1% своего заряда в сутки. Аккумуляторы же загрязненные разряжаются гораздо быстрее. Современные аккумуляторы за месяц отдыха дают 40—60% потерь (в величине запасенной энергии).
После всего сказанного о причинах «сульфации» нам нетрудно будет разобраться и в явлении саморазряда. Все тот же исследователь Фери объясняет это явление следующим образом. Кислород воздуха растворяется в электролите аккумулятора (т. е. в растворе серной кислоты), обогащает верхние слои по сравнению с более глубоким, и благодаря этому непосредственно на катоде начинают протекать процессы, которые должны были бы иметь место при нормальном разряде с участием, содержащего кислород, анода. А именно: металлический свинец катода начинает разъедаться серной кислотой в присутствии кислорода, образовывая слой недокислого сернокислого свинца, а затем в последующей стадии этот процесс саморазряда становится уже губительным, образуя из Pb2SO4 соединение сернокислого свинца PbSO4. Это соль белого цвета, известная всем, кто с грустью убеждается, что аккумулятор не работает из-за того, что оставили его c кислотой, но без периодической зарядки на долгий срок.
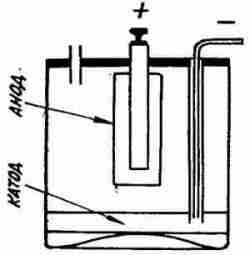
При таком объяснении явления саморазряда понятен предложенный тем же Фери новый метод расположения электродов в аккумуляторе. Он предложил катод класть горизонтально на дно аккумуляторного сосуда (рис. 4) и тем самым предохранить катод от действия кислорода вообще, и в особенности устранить указанный выше недостаток, именно, что при вертикальном положении катода он пересекает слои электролита с разным содержанием кислорода. Действительно, при горизонтальном положении катода на дне аккумуляторного сосуда скорость саморазряда во много раз уменьшается. Обычный аккумулятор теряет весь свой заряд в 4 месяца, а аккумулятор Фери с горизонтальным расположением катода к концу этого срока сохраняет до 83% своего прежнего заряда. Еще важно то, что этот последний аккумулятор, оставленный без зарядки даже на 2 года, удается вновь также просто зарядить и пустить в работу. Одним словом, Фери удалось, очевидно, во-первых, совершенно правильно объяснить процесс сульфации и, во-вторых, указать пути для уничтожения этой серьезнейшей болезни аккумуляторов — саморазряда.
1) Такими символами пользуются для обозначения различных химических элементов и их соединений. Этими же символами обозначен химический состав пластин на рис. 2 и 3.