Инж. П. Д. ДАНКОВ
Коллоидная химия недавно заняла подобающее ей место в ряду наук, изучающих природу и делающих практически—приложимые выводы. Еще лет 15—20 тому назад ее не существовало, и лишь отдельные, не связанные друг с другом факты были рассеяны по хранилищам различных областей знания. Но уже в начале настоящего столетия внимание исследователей обратилось к тем явлениям, систематизация и плодотворное разъяснение которых и создали науку о коллоидах.
Коллоидная химия по своей области применения в науке и технике настолько обширна, что дать очерк, более или менее исчерпывающий ее, в настоящей статье нет возможности. Здесь мы ограничимся лишь беглым знакомством с основными данными науки о коллоидах, с вопросом определения признаков коллоидов и, наконец, с некоторыми приложениями этой науки в задаче по выбору и приготовлению пищи. Вместе с этим мы остановимся и на некоторых других вопросах, связывающих коллоидную химию с бытом.
Мы очень много узнали о двух мирах, противоположных по своим размерам: мире материальных тел, видимых простым глазом, и мире элементов материи — молекул и атомов. В своих представлениях мы строили физические тела из молекул и атомов, как возводят здания из кирпичей. Но во многих случаях при этом мы делали ошибки, приводившие нас к заблуждениям.
Коллоидная химия нарисовала нам действительную картину. Она показала, что многое в природе и во всем том, что нас окружает, построено из частиц материи, значительно большие чем молекулы и атомы, и обладающих особенными, им только присущими свойствами. Вот их то и можно назвать кирпичами здания природы и, если позволительно углубить эту аналогию, то атомы и молекулы явятся здесь теми песчинками и частицами глины, из которых эти кирпичики сформированы.
Указанные частицы, названные коллоидными (от лат. слова "colla" — клей), образуют мускульные ткани животных (миозин и коллаген), кожу их, серум крови (фиброген и др.), белок и желток яйца (альбумины и вителлин), жиры и белки молока (казеин и лактальбумин), хлебные злаки (растительный белок, крахмал и целлюлоза), шелк (фиброген), древесину (целлюлоза), краски, ткани для одежды, почвы, многие горные породы, минералы, драгоценные камни, жемчуг, перламутр, многие металлические сплавы и еще очень многое, о чем в короткой статье не расскажешь. Но и этот краткий перечень достаточно сильно говорит о роли коллоидной химии в мировой науке.
Не нужно думать, что коллоиды — коллоидные частицы есть что-то новое и имеющее место только в лабораториях. Нет, это все наши старые знакомые, с которыми мы повседневно встречаемся. Вставая утром с постели, вы идете умываться и пользуетесь мылом, которое есть не что иное, как коллоидная система из солей жирных кислот; пена, которая получается при намыливании, тоже есть коллоидная система из коллоидных частиц жирных кислот, воды и воздуха, а самый процесс вымывания есть процесс коллоидный (объяснение которого мы дадим в дальнейшем). После умывания, вы принимаетесь за чай или кофе; и то, и другое суть типичные коллоиды, распределенные в воде; они подчиняются всем правилам, установленным коллоидной химией для подобных частиц материи. Хлеб, масло, сыр, колбаса и почти все питательные продукты, которые вы употребляете за чаем, состоят из тех же коллоидных частиц и поступают так, как и полагается всякой коллоидной системе. Отправляясь на работу, вы одеваетесь в построенное из коллоидных частиц платье, а на работе обрабатываете металлы стальными резцами, состоящими из коллоидальной смеси железа и углерода, или точите изделия из дерева, созданного из коллоида — целлюлозы, или пишете коллоидальными чернилами по бумаге, сделанной из коллоидного материала. Можно итти дальше в описании рабочего дня человека и доказать, что он всюду сталкивается с коллоидами.
Из сказанного, однако, не следует заключать, что все в природе построено из коллоидных частиц. Нередко мы можем встретить физические тела — кристаллоиды, организованные непосредственно из молекул и атомов. Но роль их в жизни и быту, конечно, менее значительна нежели роль коллоидов.
Как же отличить коллоиды от кристаллоидов? Коллоидохимики имеют для этого очень много методов, но наиболее старый способ — способ фильтрации растворов коллоидов через животные перепонки (пергамент и др.) остался и до сих пор очень надежным. При фильтровании крупные коллоидные частицы не проходят через мелкие поры перепонки, тогда как маленькие молекулы кристаллоидного вещества легко через них проникают.
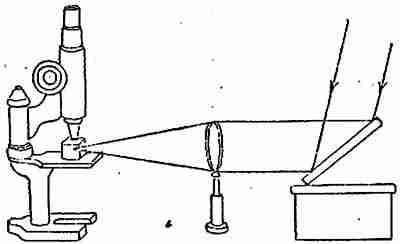
Казалось бы, микроскопом можно было бы обнаружить мельчайшие частицы. Но в том то и дело, что величина коллоидных частиц лежит как раз по средине между размерами молекул и атомов (которые для нас всегда останутся невидимыми) и величиною, обнаруживаемою наиболее совершенным микроскопом (0,001 мм). К счастью, коллоидная химия получила в свои руки могучее орудие — ультра-микроскоп, изобретенный немецким ученым Зигмонди. Принцип этого прибора можно понять по рис. 1. Стеклянный сосудик с раствором коллоида (напр. водной окиси железа или металлического золота или серебра) помещается на столик хорошего микроскопа и освещается сбоку узким пучком интенсивного света так, что часть раствора находится в фокусе собирательного стекла, поставленного между источником света и сосудиком. При этом в поле микроскопа мы увидим прекрасную картину: блестящие точки беспорядочно двигаются в темной массе раствора. Характер движения этих точек приближается к характеру общеизвестного броуновского движения. Разница здесь по существу: — в броуновском движении мы видим самые движущиеся частицы, здесь же нами наблюдаются не коллоидные частицы, а дифракционные кольца, вызванные каждой из них.

Рис. 1. Схема установки ультра-микроскопа для исследования коллоидальных растворов.
Наконец, очень простой способ, воспроизводимый во всякой, даже домашней обстановке, заключается в реализации так называемого эффекта Тиндаля. Если взять, напр. слабый раствор желатины (очень характерного коллоида) в воде и в темной комнате пропустить через него узкий пучек света, то лучи, встречая на своем пути сравнительно крупные коллоидные частицы, рассеиваются, почему мы ясно видим резко очерченную часть раствора, в которую проникает свет. Это явление подобно тому, как освещаются пылинки в воздухе в комнате с закрытыми ставнями, через щели которых проникают пучки света. И здесь коллоидное явление, т. к. пылинки (коль скоро они достаточно малы) могут быть названы коллоидными частицами. Одинаковый эффект имеет место и в случае растворов других коллоидов.
Из свойств коллоидов особенно большое значение имеет их чрезвычайная изменчивость. Они постоянно находятся в движении и постоянно изменяются, очень чутко отвечая на каждое внешнее воздействие. Эта изменчивость, вероятно, и сделала их теми необходимыми элементами животного и растительного организма, механизма, как известно очень чувствительного и изменчивого. Состояние коллоида, характеризующееся в довольно равномерном и устойчивом распределении в объеме растворителя (чаще всего воды) называется золем, когда же коллоидные частицы под влиянием какого-либо фактора собираются в более или менее крупные образования и обычно выпадают (коагулируют) в виде осадка или образуют достаточно плотный студень, тогда они носят название геля. Эти превращения коллоидных частиц иногда являются необратимыми, иногда обратимыми; т. е. напр., камен (составная часть молока) или альбумин (составная часть белка яйца) при нагревании свертываются (коагулирует) и выпадают из растворяющей среды и уже никаким способом не могут быть возвращены в прежнее состояние (состояние золя — мелкого раздробления); наоборот, другая составная часть молока — лактольбумин может каогулировать и снова вернуться в состояние золя. Действием химических (чаще электрохимических) агентов мы можем вызвать в различных коллоидных растворах явление коагуляции и обратое явление — раздробление сгустка до золя. Эти превращения имеют место во многих случаях при самом незначительном воздействии извне, и на них то изучена изумительная чувствительность коллоидов к внешним влияниям. Электролиты, т. е. большинство неорганических солей и различных кислот, в своих растворах заключают электрически заряженные частицы. Поэтому их влияние на состояние коллоидных частиц оказалось таким значительным, т. к. и сами коллоидные частицы нередко бывают отрицательно или положительно заряженными. Последний факт установлен целым рядом исследований. Чаще всего, напр., положительно заряженные частицы электролита, взаимодействуя с отрицательной частицей коллоида, вызывают его коагуляцию (свертывание, осаждение). Наблюдалось, и обратное явление, но для него имеется довольно сложное объяснение.
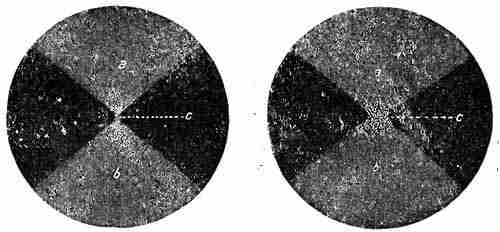
Рис. 2. Рис. 3.
На рисунках 2 и 3 изображен ход лучей в установке для ультрамикроскопического исследования коллоидальных растворов: a — световой конус сходящихся лучей в кюветке с раствором; б — световой конус расходящихся лучей; c — фокус — место отчетливого наблюдения световых точек дифракционных колец, вызванных коллоидальными частицами.
Большой интерес имеет также явление набухания студней — (напр. студня желатины, крахмала): это явление соответствует, вообще говоря, явлению перехода геля в золь, — разница лишь в том, что частицы коллоида не распределяются в объеме растворителя, а поглощают его. Изучению вопроса о набухании посвящено очень много исследований.
Благодаря своим малым размерам, коллоидные частицы, сохраняя присущее им в микроскопическом виде свойства, развивают в максимальной степени свойство поглощения своими поверхностями различных веществ. Явление поглощения, назывыемое адсорбцией, характеризуется тем, что поглощаемое вещество (напр. краска) прилипает к поверхности поглотителя (ткани) и, понятно, чем больше поверхность поглотителя, тем больше эффект поглощения (адсорбции). Поэтому то выводы коллоидной химии стали играть громадную роль в технике крашения: как ткани, так и краски почти без исключения образованы из коллоидных частиц.
Из приведенных примеров мы видим, как близки объекты коллоидной химии к домашнему быту. И, выполняя принципы НОБ'а, мы должны сделать и коллоидную химию столь же близкою нам, сколь близки нам ее объекты. В самом деле, начиная с процесса стирки белья и кончая процессом приготовлением сладкого торта, знание коллоидной химии дает возможность многое объяснить и рационально поступить в каждом отдельном случае. Еще ни одна наука так близко не подходила к вопросам быта, как коллоидная химия, и, конечно, прав был известный немецкий ученый проф. В. Оствальд, когда сказал, что "...коллоидохимик в каждой умелой стряпухе должен приветствовать своего коллегу по специальности".
Теперь задачи приготовления пищи нашли уже себе место в науке, называемой "броматикой", и недалеко то время, когда поварское искусство превратится в поварскую науку.
Всем известно, что соленую рыбу люди предпочитают есть, запивая водой. Это становится понятным, когда мы посмотрим на дело с точки зрения коллоида. Рыба — почти сплошь образована из коллоидных материалов. Попадая в желудок, они начинают набухать, т. е. как уже было указано, переходить в более раздробленные формы; вода, вводимая в желудок, вымывает из соленых продуктов (рыбы) соли, т. к. соли препятствуют набуханию. Последнее же необходимо для удобоваримости.
При исследовании молока раньше обращали внимание лишь на количество белков, жира и сахара и др., входящих в состав молока. Теперь же громадное значение придают и тому состоянию, в котором находятся эти вещества. Белки, казеин и лактальбумин, находящиеся в молоке, являются в виде коллоидов: казеина, в виде очень нестойкого и после свертывания не возвращающегося к прежнему состоянию, лактальбумина, очень стойкого и обратимого коллоида. При этом лактальбумин играет роль "защитного" вещества по отношению к казеину: он обволакивает частицы казеина и этим самым сообщает ему свои стойкие свойства. Если в молоке мало лактальбумина, то молоко может еще до скисания свернуться. Мы знаем, что, подобно лактальбумину, желатина (и многие другие коллоидные вещества), весьма стойкий коллоид, может служить в качестве "защитного" коллоида; поэтому полезно бывает добавлять в молоко желатину. Но нужно при этом знать, что при сквашивании молоко с добавкой желатины не свернется, т. к. "защитное" свойство желатины так велико, что образующиеся при сквашивании кислоты не могут свернуть (коагулировать) казеин молока. Точно так-же добавление соды в молоко препятствует свертыванию при скисании, хотя процессу (при этом сода нейтрализует кислоты) скисания не мешает. Соду добавляют и при приготовлении вегетарианских соусов, дабы молоко не коагулировало под влиянием плодовых кислот.
Другой вид пищи — мясо тоже состоит из коллоидов — миозина и коллагена. Коллоидная химия сделала уже определенные выводы о том, как различить, в каком состоянии находится мясо и удобно ли оно для употребления. По способности к набуханию (в воде) можно судить о свежести мяса; чем оно старее, тем менее способно к набуханию и тем менее удобоваримо. Телячье мясо более всего набухает в воде, тогда как свинина очень мало. Теория варки и жаренья мяса имеет тоже свои коллоидно-химические основания.
Обращаясь к такому важному продукту питания, как хлеб, мы и здесь увидим, что это коллоидная система. Мука состоит из водных гелей белка, крахмала и целлюлозы. Там же содержится небольшое количество солей и сахара. Тесто будет той же коллоидной системой — только произошел процесс набухания муки под влиянием воды. Но если мука до этого была нагрета до 60°, то обратимость гелей муки исчезает, и тесто из такой муки получить уже затруднительно, если не невозможно.
При печении теста происходят очень незначительные химические изменения, но коллоидно-химические процессы протекают очень радикально: частицы крахмала переходят в более мелкие коллоидные формы, белок, наоборот, уплотняется (коагулирует). Газы, выделяющиеся при печении, задерживаются тестом и образуют мелко раздробленную систему, что и обусловливает известную своеобразную пористую структуру хлеба. Эта пористость очень важна для удобоваримости хлеба. Коллоидная химия нашла рациональный способ определения степени пекарской пригодносги муки при помощи определения вязкости теста из нее. Чем более вязкость, тем выше пекарская способность муки.
Проблема черствения хлеба нашла свое разрешение тоже в опытах коллоидохимиков. Черствеет хлеб не от высыхания, а от особого коллоидного процесса — сиперезиса — при котором коллоидные частицы свертываются, выделяя из себя жидкость. (Явление, обратное набуханию). И здесь коллоидная химия нашла разрешение вопроса и дала способы предохранения от черствения (выдерживание при определенной температуре и опред. влажности) и посвежения хлеба при помощи умеренного нагревания.
Понятно, коллоидная химия применима не только к рассмотренным продуктам. Пересоленный бульон или соус согласно выводам кол. химии, можно исправить при помощи добавления к ним поглотителя соли, напр., риса или свежего яйца, которые в качестве коллоидов поглощают (адсорбируют) соль, выбирая ее из объема соуса и бульона.
Перечисление всех приложений коллоидной химии при выборе питательных веществ здесь невозможно. Мы остановимся еще немного на вопросе, затронутом в начале статьи, а именно на процессе вымывания мылом грязи. Здесь существенную роль играет не щелочь, как предполагалось раньше, а главным образом коллоидные частички жирных кислот. Они, находясь в постоянном (броуновском) движении, выбивают при этом частицы грязи из пор ткани и поддерживают их тоже в состоянии движения до того момента, пока струя воды не смоет пену с ткани. Вода, содержащая много солей (жесткая), коагулирует коллоиды мыла, почему эффект вымывания ткани при этом становится низким.
В журнальной статье очень трудно дать вполне точное представление о науке и ее приложениях. Однако, можно надеяться, что общее понятие о том, как ценна коллоидная точка зрения в деле рационализации питания и сопутствующих ему задач, все же можно получить и из беглого обзора рассмотренной науки.
П. Данков.