"Природа", №10-12, 1925 год, стр. 3-26
Целью настоящего очерка является описание тех кирпичиков, из которых сложена вся материя, образующая наш мир. Как дом можно рассматривать сложенным из отдельных кирпичей, скрепленных известкой, так и материю можно считать сложенной из отдельных атомов, скрепленных силами химического сродства и сцепления. Необходимо при этом отметить, что хотя мы уже много что знаем о самих кирпичиках, образующих материю, связывающие их силы нам почти неизвестны. При описании атомов я сначала остановлюсь на их величине и количестве, а затем на их весе и составе.
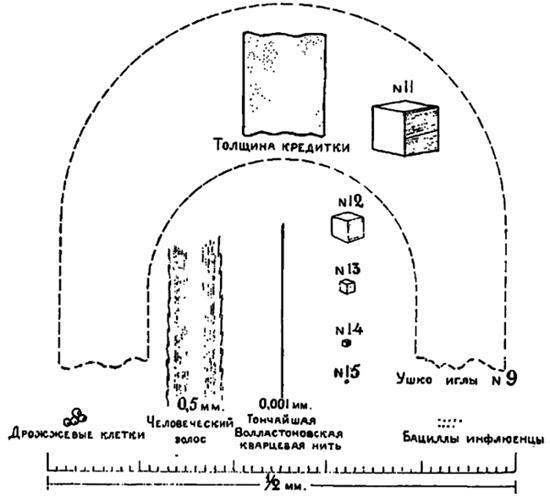
Наши органы чувств не вполне постигают того факта, что материя состоит из отдельных частиц. Поверхность чистой ртути, даже при рассмотрении под огромным увеличением микроскопа, представляется нам вполне сплошной и не выявляет в себе никакой структуры; ничтожное количество растворенной в воде краски окрасит огромное количество воды; крупинка мускуса наполнит всю комнату сильным запахом. Это указывает на то, что атомы являются чрезвычайно малыми и чрезвычайно многочисленными. Всем вероятно известен старинный спор греков о пределах раздробляемости материи; так напр., если, взяв кусок свинца, мы начнем разрезать его весьма острым ножом на все более мелкие и мелкие кусочки, когда же наступит предел этого деления? Конечно, греки этого опыта на самом деле не произвели и поэтому могли рассуждать об этом до бесконечности. Но современная наука обладает теперь такими данными, благодаря которым этот опыт может быть произведен, и хотя и не практически, то по крайней мере теоретически мы можем довести это раздробление материи вплоть до самого атома. Я постараюсь продемонстрировать это при помощи ряда рисунков. Вообразим, что мы имеем в руках кубический дециметр чистого свинца. Разрезав этот основной кубик вдоль трех взаимно перпендикулярных плоскостей, мы получим восемь производных кубиков равного размера. Каждый из этих первых производных кубиков будет обладать половиной длины основного кубика и одной восьмой его объема. Повторив подобную операцию над первым производным кубиком, мы получим второй производный кубик; разрезав второй, мы получим третий и т. д. Я хотел бы обратить ваше внимание на тот факт, что объемы членов этой серии быстро уменьшаются с возрастанием номера. После каждой операции мы получаем кубик половинной длины и одной восьмой объема предыдущего, так что объем третьего кубика будет в 500 раз меньше объема основного куба. Несмотря на все это, атомы настолько ничтожны, что лишь повторив операцию разрезания 28 раз, мы достигнем их размеров. С настоящей моделью мы деление далеко не доведем, и поэтому я продолжу эту серию при помощи рисунков.

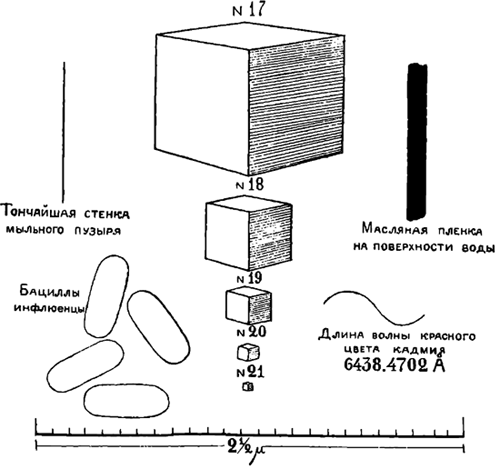
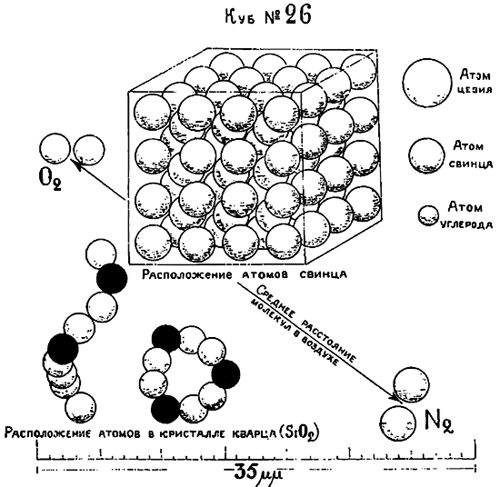
На рис. 1 изображены кубики №№11—15 наряду с некоторыми знакомыми нам предметами, нарисованными в том же масштабе. Дойдя до 15-ой операции, мы достигаем предела точности всякого рода анализа. Так, напр., обычные химические весы отметят лишь навеску не меньше девятого кубика. Кварцевые микро-весы не меньше 14 кубика, несмотря на то, что они реагируют на количество вещества весом в одну миллионную миллиграмма. Даже при помощи спектрального анализа мы отметим лишь 15-й кубик, хотя, как это и не странно, гораздо меньшие предметы могут быть наблюдаемы при помощи хорошего микроскопа. На рис. 2 изображены 17—21 кубики. Тут уже гораздо труднее подыскать подходящие предметы для сравнения. На этом рисунке видно, что световая волна, диаграмматически изображенная в виде волнистой линии, длиннее, чем толщина пленки масла на поверхности воды; это и является причиной тех радужных красок, которые мы в ней наблюдаем. Этот рисунок также нам ясно показывает, что мы никогда не сможем увидеть атома, размеры которого гораздо меньше самой короткой световой волны, могущей еще быть воспринятой человеческим глазом. На рис. 3 изображен 26-ой кубик и тут же можно видеть, что последующие две операции приведут его к размерам единичного атома. В данном случае мы уже не имеем предметов для сравнения. На этом рисунке диаграмматически в виде сфер изображены некоторые атомы: атом цезия — наибольший из всех, атом свинца — средних размеров и атом углерода — наименьший. Хотя атомы и изображены в виде сфер, отнюдь не надо предполагать, что они на самом деле являются материальными шариками. Тут же изображены молекулы кислорода и азота на расстоянии, соответствующем их среднему расстоянию в обыкновенном воздухе. Молекулы газов и паров являются в виде простых соединений атомов: молекулы азота и кислорода сложены из двух атомов каждая. Молекулы водяных паров состоят из трех атомов — двух водородных и одного кислородного. Наши знания о размерах атомов и о их группировке в твердых телах в настоящее время весьма расширились благодаря работам Браггов и других ученых. Относительно же их количества в данном объеме материи мы весьма точно узнаем путем косвенных электрических измерений.
Дать вам точное представление о количестве атомов было бы весьма трудной задачей, ибо количество их огромно. Если бы мы, например, взяли бы все атомы, заключающиеся в нашем основном (кубическом дециметре) кубе и уложили бы их вдоль прямой линии, на взаимном расстоянии друг от друга, равном их взаимному расстоянию в свинце, то эта линия протянулась бы на расстояние шести миллионов миль. Лучу света понадобился бы целый год, чтобы пробежать это расстояние, настолько оно огромно. В виде другой иллюстрации количества атомов, возьмем, например, обыкновенную электрическую лампочку, из которой выкачан воздух, и просверлим в ней отверстие, позволяющее молекулам воздуха проходить во внутрь в количестве одного миллиона в секунду. Для того, чтобы наполнить всю лампочку воздухом, нам, в данном случае, потребовалось бы сто миллионов лет. Но быть может в виде наиболее убедительного примера мы приведем следующий воображаемый опыт. Предположим, что мы могли бы отметить все молекулы, находящиеся в стакане воды таким образом, что впоследствии мы могли бы их легко распознать. Предположим дальше, что эта вода была бы вылита нами где-нибудь на земной поверхности, а затем мы покинули бы землю на несколько миллионов лет для того, чтобы предоставить полную возможность равномерного смешения воды, находившейся в стакане, с водами всех океанов, озер, рек и т. п. Затем, вернувшись на землю, мы бы наполнили наш стакан водой из ближайшего крана. Сколько же отмеченных нами молекул мы смогли бы найти в этом стакане? Ответ: 2000 молекул, ибо молекул в стакане воды в 2000 раз больше, чем стаканов воды на всей земной поверхности!
Глядя на подобные цифры, казалось бы совершенно безнадежным делать попытку изучать отдельные атомы, но на самом деле это не так. Современная физика получила возможность наблюдать действие отдельного атома, двигающегося с огромной скоростью. Вес отдельного атома, даже и самого тяжелого, слишком ничтожен для того, чтобы быть отмеченным нашими чувствами, но, придав ему огромную скорость, мы получим достаточно энергии, которая сможет подействовать на наши органы чувств или же на фотографическую пластинку. Благодаря этому факту мы теперь получили возможность в точности сравнивать между собой веса отдельных атомов, хотя и задолго до того наши знания относительных весов атомов сыграли огромную роль в деле развития химии.
Больше ста лет тому назад Дальтон в своей атомной теории выдвинул следующее основное положение: атомы одного и того же элемента вполне одинаковы как по своим свойствам, так и по весу. Вскоре после опубликования этой простой идеи, Проут предложил другую гипотезу, согласно которой атомы всех элементов сами в свою очередь образованы другими частицами еще более основного вещества, которое он назвал "протилом" и которое он пытался приравнять к легчайшему из всех известных элементов — водороду. Если признать, что Дальтон и Проут оба были правы в своих положениях, то мы должны были бы иметь атомные веса всех элементов, выраженные целыми числами. На самом же деле, как это было вскоре выяснено химиками, положение усложнялось тем фактом, что атомные веса элементов отнюдь не выражались целыми числами. Конечно, многие элементы обладали целыми атомными весами или же близко к ним приближающимися, при условии принятия атомного веса кислорода равным 16, и этот факт являлся весьма знаменательным. Простая случайность не могла объяснить этого факта, но все же многие элементы, подобно хлору, никак не могли быть подведены под закон целых чисел. Как только этот факт оказался окончательно выясненным, химикам пришлось решить вопрос, которую же из гипотез они должны признать за истинную: гипотезу Дальтона или же Проута, и неудивительно, что они избрали первую, которую в настоящее время мы уже считаем ложной. Но тогда они несомненно были правы, ибо с их точки зрения эта теория была наиболее простой. Гораздо важнее для рабочей гипотезы быть простой, чем быть истинной, ибо простую гипотезу легче осмыслить и на ее основе повести ряд опытных исследований, в то время как более сложная гипотеза делает исследователя настолько осторожным и критическим ко всякого рода опытам, что он их никогда и не производит. Нам необходимо удерживать простые гипотезы до тех пор, пока они окончательно не будут опровергнуты новыми опытными данными и тогда они должны быть оставлены лишь в крайней необходимости. Можно сказать, что Дальтоновская гипотеза была принята вполне разумно, так как она привела нас к изумительному прогрессу в области химии, несмотря на то, что, как теперь это вполне выяснено, она во многих отношениях ошибочна.
Подойти к этому вопросу путем химических исследований невозможно. Химия изучает свойства большого количества атомов и дает лишь средние результаты. Впервые Дальтоновский принцип получил удар из области радиоактивных исследований, когда Содди открыл тот факт, что свинец, извлеченный из ториевых минералов, и свинец, извлеченный из урановых минералов обладают различными атомными весами. Это открытие означало то, что могли существовать вещества, обладающие одинаковыми химическими свойствами, но различными атомными весами. Подобные вещества были названы Содди — изотопами. К сожалению, этот метод не мог быть применен ко всем веществам, ибо свинец был единственным из элементов, являющимся результатом радиоактивного распада. Для прочих же элементов решающим опытным исследованием является прямое сравнение атомных весов отдельных атомов.
Для того, чтобы взвесить атом, мы должны ему сначала придать электрический заряд. Всего удобнее это произвести при помощи электрического разряда сквозь разреженный газ. В разрядной трубке в напряженном поле перед самым катодом атомы раздробляются, или иначе говоря "ионизируются". Отрицательно заряженные частицы атомов отталкиваются катодами и образуют, так называемые, катодные лучи. Эти лучи состоят из потока электронов — атомов отрицательного электричества. Катодные лучи всегда одинаковы и не зависят от характера газа, помещенного в трубку. Кроме этих лучей, существуют также положительные лучи, несущиеся по направлению катода. Они образованы теми атомами газа, из которых несколько электронов были выбиты при разряде и которые этим самым приобрели положительный заряд. Если мы пробуравим катод насквозь и дадим возможность положительным лучам выйти за его пределы, мы тем самым сделаем их доступными анализу. Сэр Дж. Дж. Томсон предложил, так называемый, метод "параболы" для анализа положительных лучей. Этот метод заключается в следующем: достигнув поверхности катода, положительные лучи проходят сквозь тонкую и длинную металлическую трубочку, и этим путем мы получаем тонкий пучок лучей, который подвергается действию сопряженного электрического и магнитного поля, а затем падает на фотографическую пластинку. При таких условиях, как нам это показывает обыкновенная динамика, группа атомов, обладающих одним и тем же отношением между массой и зарядом, но различными скоростями, оставит на фотографической пластинке след в виде параболы. Так как заряд, несомый атомом, равен заряду одного или нескольких электронов, то атомы различной массы образуют отдельные параболы. Измерив относительное положение этих парабол на фотографической пластинке, мы сможем высчитать относительную массу атомов, их образующих. Все это сводится к сравнению веса отдельных атомов и молекул, которые входят в состав положительных лучей. При помощи этого метода целый ряд элементов был изучен и на первых порах результаты явились нам как будто подтверждающими гипотезу Дальтона, а именно то обстоятельство, что следы на пластинке были в виде резко очерченных парабол, а не в виде неопределенных пятен, что говорило в пользу того, что атомы одного и того же элемента обладают, хотя бы даже и приблизительно, одинаковым атомным весом.
Когда же в 1912 году редкий газ неон был подвергнут этому анализу, результатом оказалось новое весьма интересное явление, а именно, что вместо одной параболы его спектр показал двойную параболу. Наиболее интенсивная из этих двух парабол приблизительно соответствовала атомному весу — 20, другая менее интенсивная — атомному весу 22. Атомный вес неона, определенный химическим путем, равен 20,20. У нас не было никакого основания ожидать появления параболы 22. Присутствием посторонних примесей она объяснена быть не может, а тем не менее, каждый раз, как неон присутствовал в разрядной трубке обе параболы появлялись на пластинке. Из всего этого вполне вероятным становилось то предположение, что подобно продуктам радиоактивного распада, исследованным Содди, могли также существовать и среди обыкновенных элементов атомы, обладающие одинаковыми химическими свойствами, но различным атомным весом. Согласно этому предположению параболы спектра неона образованы двумя его составными частями, т.-е. изотопами. Это соображение заставило меня попытаться разделить эти две гипотетические составные части газа неона. Первым методом явилась фракционированная перегонка неона в присутствии древесного угля, охлажденного при помощи жидкого воздуха. Так как после 3000 дестилляций никакой разницы в атомном весе не было замечено, то можно было сказать, что разделение было неудачным. В настоящее время нам уже понятно, что иначе и не могло быть, так как изотопы обладают почти одинаковой точкой кипения. Оставалась другая более надежная возможность разделения. При диффузии газа через пористую глиняную перегородку, легкие атомы должны проходить сквозь нее быстрее, чем тяжелые. Конечно, операция подобного рода сопряжена с огромными трудностями, но все же после большого числа повторных диффузий через глиняную перегородку, я нашел разницу в плотности двух газовых фракций равной около 0,7%. Это число во много раз превышало возможную ошибку опыта и было вполне достаточным для утверждения того, что мое объяснение парабол было вполне правильным. Война, к сожалению, прервала мои опыты на этой стадии исследования и вопрос продолжал оставаться открытым.
По возобновлении исследований стало вполне очевидно, что разделение изотопов при помощи диффузионного метода, помимо его сложности, было не вполне убедительным, так как разницу в плотности всегда можно было объяснить присутствием посторонних примесей. Поэтому я опять вернулся к своему первоначальному методу анализа при помощи положительных лучей, надеясь достичь такого совершенства, что можно было бы с точностью отличить параболу 22 от ожидаемой параболы 20,2. Если бы удалось нам показать, что получаемые параболы лежали по обеим сторонам среднего атомного веса неона с ним не совпадая, то, конечно, все стало бы очевидным, но метод "параболы" этого дать не мог, так как его точность равнялась около 1%.
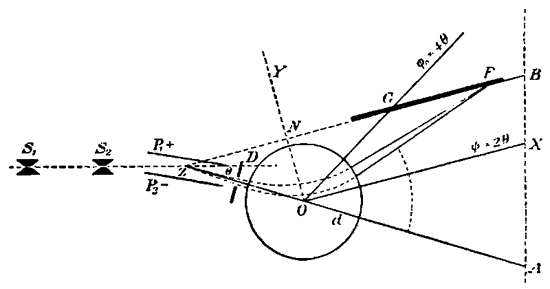
Желаемая точность была тем не менее достигнута при помощи аппарата, диаграмматически изображенного на рис.4. В этом аппарате положительные лучи выделяются в тонкий пучок при помощи двух щелей S1 и S2. Пучок этот раздробляется в электрический спектр при прохождении между двумя заряженными пластинками P1 и Р2. Часть этого спектра, отклоненная на угол θ, диафрагмируется при помощи щели D и пропускается между полюсами магнита О, поле которого так расположено, что пучок отклоняется обратно на угол ϕ, больше чем в два раза превышающий угол θ. Результатом всех этих операций явится то, что лучи, образованные атомами, обладающими одинаковой массой (точнее — одинаковым отношением массы к заряду — m/e), сосредоточиваются в полюсе F. Поместив фотографическую пластинку GF, как показано на рисунке, мы получим возможность сфотографировать спектр положительных лучей. Благодаря сходству этого аппарата с обычным оптическим спектрографом, он был назван спектрографом масс, а полученный спектр — спектром масс. На рис. 5 изображено несколько подобных спектров. Цифры, стоящие против линий, соответствуют атомным весам (атомный вес кислорода принимался равным 16). Ясно видно, что эти спектры показывают приблизительно линейное возрастание масс при продвижении слоев направо вдоль спектра. В данном случае мы измеряем массы не в абсолютных единицах, а лишь относительно тех линий, соответствующие массы которых с достоверностью известны. Подобные контрольные линии мы получаем от водорода, углерода, кислорода и их соединений. Они обыкновенно присутствуют в разрядной трубке или же в виде посторонних примесей или же нарочно туда введены, так как чистые газы не вполне пригодны для успешного ведения опыта. Главными контрольными линиями являются нижеследующие: группа С, состоящая из С(12), СН(13), СН2(14), СН3(15), СН4 или O(16) и группа С2Н6(24—30), заключающая в себе весьма интенсивную линию C2H4 или СО(28). Эти группы видны на многих из изображенных спектров и вместе с линией СO2(44) они служат нам очень хорошей контрольной шкалой. Путем этого метода массы атомов могут быть измерены с точностью до 1:1000.
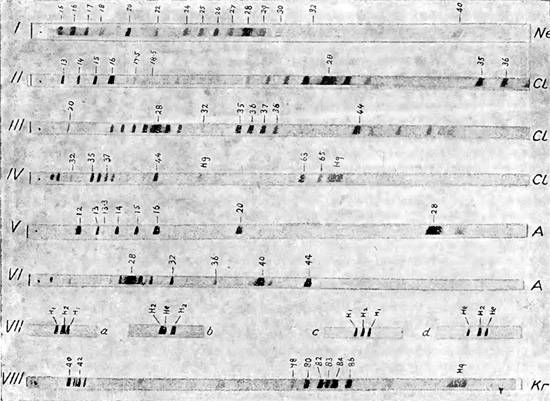
Но необходимо помнить, что спектр отмечает лишь отношение массы к заряду, а некоторые атомы способны нести на себе двойной, тройной и даже больший заряд. Очевидно, что кажущаяся масса частицы, несущей на себе двойной заряд, будет равняться половине массы частицы, несущей единичный заряд, тройной — трети и т. д. Линии, образованные подобными частицами, носят название линий второго и третьего разряда. Линии высших разрядов особенно ценны для нас, как расширяющие контрольную шкалу. При введении в трубку неона четыре новых линии (10, 11, 20, 22) появились на спектре, и первые две очевидно являются линиями второго разряда. Все эти четыре линии были достаточно резко очерчены для того, чтобы быть сравненными с контрольными линиями. Целый ряд точных измерений показал, что атомные веса изотопов, составляющих неон, равны 20 и 22. Десять процентов изотопа 22 в смеси с изотопом 22 дают нам искомую величину 20,2 соответствующую химическому атомному весу неона. Относительная интенсивность этих линий также вполне подтверждает это предположение. Все это вполне доказывает, что неон образован двумя изотопами. Спектр I показывает линии неона первого разряда наряду с некоторыми контрольными линиями, с которыми они были сравнены.
Следующим элементом, подвергнутым этому анализу, был хлор, и нам стало вполне ясно, почему он обладает дробным атомным весом (35,46). Массовый спектр хлора характеризуется четырьмя интенсивными линиями — 35, 36, 37, 38. Простейшее объяснение этой группы заключается в предположении, что линии 35 и 37 образованы двумя изотопами хлора, а линии 36 и 38 их соответствующими хлоро-водородными кислотами. Их принадлежность к первому разряду указывается присутствием линий второго разряда — 17,5 и 18,5, а также линиями 63 и 65, образованными молекулами фосгена — COCl235 и СOС1237. Впоследствии нам удалось получить отрицательно заряженные атомы хлора, дающие лишь две линии 35 и 37 и это показало, что линии 36 и 38 не могут быть образованы изотопами хлора. Все это ведет к заключению, что хлор является сложным элементом, состоящим из двух изотопов атомного веса 35 и 37. Спектры II, III и IV показывают нам результаты этого анализа.
Массовые спектры аргона (V и VI) показывают весьма интенсивную линию — 40, линию второго разряда — 20 и третьего разряда — 13⅓. Последняя особенно хорошо расположена среди известных контрольных линий и ясно показывает, что она образована атомом атомного веса 40, несущим на себе тройной заряд. Химический атомный вес аргона немного меньше сорока, что указывает на присутствие более легкого изотопа. Этот изотоп был найден равным 36-ти и его существование теперь вполне доказано. 3% этого легкого изотопа в смеси с изотопом 40 дает нам искомый атомный вес аргона. Тяжелые благородные газы дают нам весьма сложные, но интересные результаты. Криптон характеризуется спектром, заключающим в себе группу из пяти интенсивных линий — 80, 82, 83, 84, 86 и одной менее интенсивной — 78. Эта группа великолепно воспроизведена с одинаковой относительной интенсивностью во втором разряде и с меньшей интенсивностью — в третьем. Группы второго и третьего разряда позволяют нам точно высчитать массы изотопов, так как линии второго разряда могут быть сравнены с линией аргона — 40, а линии третьего разряда — с СО (28). Атомные веса всех изотопов криптона являются целыми числами, измеренными с точностью до 1:1000. Группы первого и второго разрядов ясно видны на левой и правой стороне спектра VIII. Спектр ксенона еще более сложен. Он состоит из пяти интенсивных линий — 129, 131, 132, 134, 136 и двух менее интенсивных — 128, 130; кроме того, новейшие исследования показали вероятность присутствия двух весьма слабых линий — 124, 126, так что в общей сложности ксенон обладает девятью линиями. Еще в самом начале исследований было доказано, что ртуть также состоит из смеси изотопов, но линии ее спектра настолько близки друг от друга, что при современных методах разложить их было невозможно. Ее группы первого, второго и высших разрядов группируются вокруг масс 200, 100, 66¾ и т. д. Некоторые из них видны на приложенных спектрах. В общей сложности из 80 нам известных устойчивых элементов 56 были проанализированы при помощи этого метода. Некоторые из них оказались простыми элементами, другие состоящими из смеси изотопов. Результаты этого исследования показаны на прилагаемой таблице.
| Эле- мент. |
Атом- ное число. |
Атом- ный вес. |
Мини- мальное число изотопов. |
Массовое число изотопов. |
| H | 1 | 1,008 | 1 | 1 |
| Не | 2 | 4,00 | 1 | 4 |
| Li | 3 | 6,94 | 2 | 7, 6 |
| Be | 4 | 9,02 | 1 | 9 |
| В | 5 | 10,82 | 2 | 11, 10 |
| С | 6 | 12,00 | 1 | 12 |
| N | 7 | 14,01 | 1 | 14 |
| О | 8 | 16.00 | 1 | 16 |
| F | 9 | 19.00 | 1 | 19 |
| Ne | 10 | 20,20 | 2 | 20, 22 |
| Na | 11 | 23,00 | 1 | 23 |
| Mg | 12 | 24,32 | 3 | 24, 25, 26 |
| Al | 13 | 26.96 | 1 | 27 |
| Si | 14 | 28,06 | 3 | 28, 29, 30 |
| P | 15 | 31,02 | 1 | 31 |
| S | 16 | 32,06 | 1 | 32 |
| Cl | 17 | 35,46 | 2 | 35, 37 |
| A | 18 | 39,88 | 2 | 40, 36 |
| К | 19 | 39,10 | 2 | 39, 41 |
| Ca | 20 | 40,07 | 2 | 40, 44 |
| Sc | 21 | 45,1 | 1 | 45 |
| Ti | 22 | 48,1 | 1 | 48 |
| V | 23 | 51,0 | 1 | 51 |
| Cr | 24 | 52,0 | 1 | 52 |
| Mn | 25 | 54,93 | 1 | 55 |
| Fe | 26 | 55,84 | 2 | 56, 54 |
| Со | 27 | 58.97 | 1 | 59 |
| Ni | 28 | 58,68 | 2 | 58, 60 |
| Cu | 29 | 63,57 | 2 | 63, 65 |
| Zn | 30 | 65,38 | 4 | 64, 66, 68, 70 |
| Ga | 31 | 69,72 | 2 | 69, 71 |
| Ge | 32 | 72,38 | 3 | 74, 72, 70 |
| As | 33 | 74,96 | 1 | 75 |
| Se | 34 | 79,2 | 6 | 80, 78, 76, 82, 77, 74 |
| Br | 35 | 79,92 | 2 | 79, 81 |
| Kr | 36 | 82,92 | 6 | 84, 86, 82, 83, 80, 78 |
| Rb | 37 | 85,44 | 2 | 85, 87 |
| Sr | 38 | 87,63 | 2 | 88, 86 |
| Y | 39 | 88,9 | 1 | 89 |
| Zr | 40 | (91) | 3(4) | 90, 94, 92, (96) |
| Ag | 47 | 107,88 | 2 | 107, 109 |
| Cd | 48 | 112,41 | 6 | 114, 112, 110, 113, 111, 116 |
| In | 49 | 114,8 | 1 | 115 |
| Sn | 50 | 118,70 | 7(8) | 120, 118, 116, 124, 119, 117, 122, (121) |
| Sb | 51 | 121,77 | 2 | 121, 123 |
| Те | 52 | 127,5 | 3 | 128, 130, 126 |
| I | 53 | 126,92 | 1 | 127 |
| X | 54 | 130,2 | 7(9) | 129, 132, 131, 134, 136, 128, 130, (l26), (124) |
| Cs | 55 | 132,81 | 1 | 133 |
| Ba | 56 | 137,37 | (1) | 138 |
| La | 57 | 138,91 | 1 | 139 |
| Ce | 58 | 140,25 | 2 | 140, 142 |
| Pr | 59 | 140,92 | 1 | 141 |
| Nd | 60 | 144,27 | 3(4) | 142, 144, 146, (145) |
| Hg1) | 80 | 200,6 | (6) | (197), 202, 204, 198, 199, 200 |
| Bi | 83 | 209,00 | 1 | 209 |
Самым важным результатом этого исследования оказался тот факт, что, за исключением водорода, атомные веса всех нами измеренных элементов (по всей вероятности и всех известных элементов) могут быть выражены простыми числами, принимая во внимание, что измерения были произведены с точностью до 1:1000. Конечно, точность измерения, выраженная в процентах веса, уменьшается с увеличением измеряемого веса, но для легких элементов она должна быть весьма незначительной. Это обобщение, названное "законом простых чисел", окончательно смело последнюю преграду, стоящую на пути к признанию электрической теории материи. В конечном итоге закон этот возрождает старую теорию Проута, выраженную в терминах современной физики, и мы теперь в праве предполагать, что атомы всех элементов образованы частицами электричества. Частицы эти двойного рода: положительные носят название протонов, отрицательные — электронов. Протон, хотя и гораздо меньше по размерам чем электрон, в 1.800 раз тяжелее его. Каждый электрический нейтральный атом содержит в себе одинаковое количество электронов и протонов. Принимая вес одного протона за единицу, вес атома, следовательно, будет приблизительно равняться числу заключенных в нем протонов; это число мы будем называть массовым числом. Так например, атом водорода состоит из одного протона и одного электрона; атом гелия — из четырех протонов и четырех электронов, легкий изотоп лития — из шести электронов и шести протонов, тяжелый изотоп лития — семи электронов и семи протонов и т. д.
Мы теперь постараемся рассмотреть, каким образом эти электрические заряды, т.-е. тяжелые протоны и легкие электроны, сгруппированы в атоме. Из всех многочисленных гипотез о структуре атома, предложенных со времени открытия радиоактивности, одна лишь удержалась и в настоящее время стала общепринятой. Это так называемая "ядровая" теория сэра Эрнеста Рудзефорда. Несмотря на то, что атом, построенный на основании этой теории, во многих отношениях не согласуется с принципами классической механики, теория эта стала не только общепринятой, но, принимая во внимание все те суровые испытания, которые ей пришлось выдержать в руках современных исследователей, можно утверждать, что она должна в своих общих чертах отвечать действительности. Согласно этой теории, в нормальном атоме все протоны и почти половина всего числа электронов сгруппированы в одно массивное центральное ядро, вокруг которого вращаются остальные электроны. Таким образом атом является своего рода миниатюрной солнечной системой, в которой положительно заряженное ядро играет роль солнца, а отрицательно заряженные электроны, вращающиеся вокруг него вдоль своих орбит, играют роль планет. Но мы при этом не должны забывать одной основной разницы, существующей между этими двумя системами. В то время как в солнечной системе орбиты всех планет находятся приблизительно в одной плоскости, электронные орбиты в атоме расположены в различных плоскостях, так что мы отчасти вправе считать, что атом занимает сферическую часть пространства. Но еще более основной разницей является то обстоятельство, что в то время как в солнечной системе планеты удерживаются в своих орбитах силой тяготения, в атоме движение электронов регулируется исключительно лишь электрическим зарядом ядра и не зависит от масс частиц. Размеры атома определяются размерами внешней электронной орбиты. Все химические и спектроскопические свойства атома всецело зависят от движения его планетарных электронов, а это, в свою очередь, зависит от силы притяжения ядра, так что становится очевидным, почему мы принимаем заряд атомного ядра как наиболее основное свойство, определяющее собой все остальные качества. Чтобы согласовать постулат Дальтона с современными научными взглядами, мы должны его выразить в следующей формулировке: атомы одного и того же элемента обладают одинаковыми свойствами, потому что их положительные ядра несут одинаковые заряды. Этот положительный заряд ядра, т. е. разница между числом протонов и электронов, заключенных в ядре, и есть "Мозелеевское" порядковое число. Оно определяет порядок элемента в периодической системе; порядковое число водорода — 1, гелия — 2, лития — 3 и т. д. вплоть до урана, заряд ядра которого и его порядковое число равно 92.
Существование изотопов мы можем объяснить тем фактом, что орбиты планетарных электронов являются функцией не массы ядра, а его заряда. Возьмем для примера довольно простой атом, имеющий в своем ядре 6 протонов и 3 электрона, а также 3 планетарных электрона. Заряд его ядра, т.-е. его порядковое число, равняется 3-м, а его атомный вес равняется числу протонов в ядре, т.-е. 6-ти. Предположим теперь, что мы введем в этот атом один протон и один электрон. Ядро новообразованного атома будет теперь состоять из 7-ми протонов и 4-х электронов. Заряд ядра останется тем же (7 — 4 = 3), а так как заряд ядра является единственной силой, влияющей на планетарные электроны, то химические и спектроскопические свойства атомов не изменятся, в то время как вес первого будет 6, а второго — 7. Подобные атомы называются изотопами и мы их на самом деле наблюдаем в элементе лития. Теоретически мы можем вообразить, что этот процесс введения в атом одного протона и одного электрона можно повторять до бесконечности, не изменяя заряда ядра, и тем самым создать бесконечное число изотопов. Если же мы перенесем один электрон из ядра в область планетарных электронов и тем самым изменим заряд ядра, то все свойства атома, за исключением его атомного веса, изменятся. Вещества, обладающие одним и тем же атомным весом и массовым числом, но различными химическими свойствами, получили название "изобар". Наиболее разительным примером изобар являются главные изотопы газа аргона и металла кальция. Хотя никакой разницы в их атомных весах (40) не было отмечено, трудно себе представить два вещества, которые столь отличались бы друг от друга по своим свойствам.
Я нарисовал вам картину атома, состоящего из центрального ядра и системы внешних электронов. Когда же мы подходим к вопросу относительных размеров этих электрических частиц, то нас встречают совершенно неожиданные результаты. Размеры протонов и электронов бесконечно малы по сравнению с самим атомом. Было бы совершенно безнадежным представить это в виде числовых данных. Изобразив атом размером в купол собора св. Петра в Лондоне, мы с трудом различили бы в нем электроны, размеры которых не превышали бы булавочную головку, протоны же были бы величиной с пылинку, совершенно невидимой глазу. Увеличив ядро гелия до размеров горошины, нам пришлось бы поместить планетарные электроны на расстоянии одной четверти мили. Все опытные данные указывают нам на то, что материя является необыкновенно пустой. Атом, даже столь тяжелого элемента как свинец, столь же разрежен, насколько разрежена наша солнечная система, и лишь благодаря быстрому и непрерывному движению внешних электронов получается иллюзия, что он занимает определенный сферический объем пространства.
За последнее время многим пришлось слышать фантастические рассуждения "о раздроблении атома". Каждый раз, когда мы вынимаем самопишущее перо из кармана, мы раздробляем неисчислимое количество атомов, так как при трении эбонита о сукно множество планетарных электронов отрываются от ядер. Об этом методе раздробления атомов я уже упоминал, говоря о "ионизации". Непоправимого вреда атом при этом не испытывает. Захватив первый попавшийся на его пути электрон, для замещения потери, и радостно известив весь мир о своей победе тем беспроволочным сигналом, который мы называем светом, атом продолжает свое прежнее существование. В медной проволоке переход электронов от атома к атому совершается с необыкновенной быстротой и из этих свободных, перебегающих электронов и состоит электрический ток.
Говоря о подобном раздроблении атомов, необходимо все же отметить, что в данном случае мы имеем лишь дело с внешними электронами. В отношении ядра дело обстоит иначе. Чтобы его раздробить, необходима гораздо большая сила, но раз ядро раздроблено, то весь атом меняется и меняется навсегда. Тут мы уже имеем дело с трансмутацией элементов, а не простой ионизацией. Эта трансмутация элементов, заветная мечта алхимиков, непрерывно происходит среди радиоактивных элементов, ядра которых находятся в состоянии неустойчивого равновесия и постоянно излучают альфа- и бета-лучи, состоящие из заряженных атомов гелия (лучи-альфа) и электронов (лучи-бета). Первая попытка искусственного раздробления атомных ядер была сделана несколько лет тому назад Рудзефордом, который подверг бомбардировке атомы легких элементов лучами альфа. Эти лучи состоят из частиц гелия, несущихся со скоростью большей чем 100.000 миль в секунду, но для успешного раздробления атома подобная частица должна попасть прямо в ядро. При подобном столкновении частица гелия выбивает один протон из ядра атома и тем самым производит превращение одного элемента в другой. Недавно, опыты Рудзефорда были подтверждены Блакетом, который, пользуясь изящным методом Вильсона (наблюдение следа, оставленного движущейся частицей в искусственном тумане), получил фотографии момента разбивания ядра азота под действием удара быстро движущейся альфа-частицы. Эти опыты были произведены в лаборатории Рудзефорда. Как мною это уже было отмечено ранее, размеры ядра ничтожны по сравнению с размерами самого атома. Можно теоретически вычислить, что из десяти тысяч встреч альфа-частиц с атомами происходит одно прямое попадание. Поэтому, несмотря на то, что каждая альфа-частица во время своего пробега сталкивается приблизительно с 200.000 атомами, огромное количество фотографий было необходимо для того, чтобы получить необходимые данные. Пришлось сфотографировать около 400.000 следов для того, чтобы получить 8 снимков распада. На этих снимках ясно можно было различить след выбитого протона; кроме того они выявили также совершенно неожиданный факт, а именно, что снаряд (т.-е. альфа-частица) всегда застревал в разбиваемом ядре. Таким образом ядро атома азота теряло один протон, но в то же самое время приобретало ядро атома гелия, с которым оно сталкивалось, становясь тем самым изотопом кислорода, атомного веса 17. Подобное вещество в природе неизвестно и это указывает на то, что подобный атом неустойчив.
Дальнейшее развитие подобного рода искусственных трансмутаций атомов быть может сыграет огромную роль в деле использования атомной энергии. Закон целых чисел математически не вполне точен и непосредственные измерения массового спектра показали, что атом гелия, состоящий из четырех протонов, двух ядровых электронов и двух планетарных электронов, обладает весом на 1% меньшим чем вес четырех атомов водорода, каждый из которых состоит из одного протона и одного электрона. Число частиц в одном атоме гелия и четырех атомах водорода, следовательно, одинаково и уменьшение массы можно лишь объяснить особенным расположением этих частиц в атоме гелия, так наз. "эффект сложения" (packing effect). Таким образом, если бы нам удалось превратить водород в гелий, произошло бы уничтожение части массы, сопровожденное выделением энергии. Согласно теории относительности, количество этой энергии, приходящейся на небольшое количество материи, огромно. Так, например, при превращении водорода, заключающегося в стакане воды, в соответствующее количество гелия выделилось бы достаточно энергии для того, чтобы трансатлантический пароход "Мавритания" мог бы пройти из Европы в Америку и обратно. Подобного рода превращения по всей вероятности происходят внутри звезд, но мы находимся еще далеко до того времени, когда это будет возможно производить в лаборатории. Все-же я не сомневаюсь, что когда-либо человек получит возможность освобождать и контролировать эту могучую силу. Будучи достаточно оптимистичным, я надеюсь, что эта освобожденная энергия не пойдет всецело на взаимное истребление человечества.
В этом очерке я попытался дать вам представление о тех атомных частицах, из которых сложена вся наша вселенная, подобно тому, как дом сложен из кирпичей. Но как и кирпич сложен из частиц глины, так, в свою очередь, и атом сложен из других более мелких частиц. Каждый шаг, сделанный по направлению анализа бесконечно малого, открывает перед нами все новые и новые чудеса, расстилающиеся вдоль далеких горизонтов нашего разума. Современному исследователю нечего приходить в отчаяние подобно Александру Македонскому. Каждый из многочисленных атомов, из которых сложен наш чудесный мир, заключает в себе целый космос, заключает в себе новую область действия неведомых и огромных сил, каждый из таких атомов является для современного исследователя новым миром, который он может открыть и покорить.
Перевод С. Томкеева.
1) По новейшим данным Астона (Nature, Aug. 8, Decemb. 19, 1925 г.) изотопы ртути: 202, 200, 199, 198, 201 и 204 (прим. редакции).
(стр. 19.)